Профессор Полина Степенски Руководитель отделения ТКМ и иммунотерапии у детей и взрослых клиники «Хадасса»
В клинике «Хадасса» успешно вылечивают аппластическую анемию с помощью трансплантации костного мозга. Лечение проводится под руководством известного трансплантолога, заведующей отделением ТКМ и иммунотерапии у детей и взрослых проф. Полины Степенски.
Генетической диагностикой заболевания занимается команда опытных специалистов, которую возглавляет всемирно известный врач и ученый проф. Орли Эльпелег.
Общие сведения, что такое апластическая анемия (разновидности, формы)
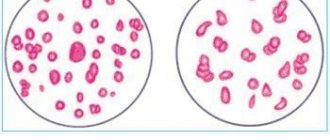
Одной из патологий костномозгового кроветворения, угнетающей продукцию кровяных клеток — лейкоцитов, эритроцитов и тромбоцитов, является апластическая анемия. Симптоматика заболевания обусловлена тромбоцитопенией, лейкопенией и анемией. Ключевые признаки апластической анемии: кожные геморрагии, кровоточивость слизистых оболочек, слабость, одышка, воспаления, инфекции. Диагноз подтверждается на основе результатов гистоморфологического анализа биоптата, миело- и гемограммы. При апластической анемии применяют иммуносупрессивную терапию, гемотрансфузии, ТКМ.
Апластическая или гипопластическая анемия (АА) представляет собой тяжелое расстройство гемопоэза, сопровождающееся инфекционными осложнениями, а также геморрагическим и анемическим синдромом. В 1988 году патология была впервые описана немецким иммунологом и лауреатом Нобелевской премии П. Эрлихом (Paul Ehrlich). Как правило, при апластической анемии нарушена выработка всех видов кровяных клеток, но в некоторых случаях костный мозг не способен нормально вырабатывать только эритроциты. На основе данного фактора заболевание разделяют на парциальную и истинную апластическую анемию (пангемоцитопению). Встречаемость болезни составляет 2-4 случая на 1 млн. населения в год. Может возникать как у детей, так и взрослых с аналогичной частотой у обоих полов. Пик заболеваемости у детей приходится на 9-10 лет, у взрослых 25-27 и 50-60 лет.
Чтобы получить более подробную информацию или консультацию специалиста по орфанным заболеваниям, заполните все поля формы. Наши консультанты будут рады Вам помочь.
Существует приобретенная и врожденная форма апластической анемии. В первом случае заболевание развивается на протяжении жизни вследствие эндогенных факторов и внешних воздействий. Во втором, апластическая анемия возникает на фоне хромосомных нарушений. Этиология приобретенной формы в большинстве случаев не известна. Лишь у 20 % пациентов идентифицируют этиологический фактор приобретенной АА. Врожденная форма заболевания характерна для детей 8-10 лет. В зависимости от происхождения, апластическую анемию классифицируют на идиопатическую, гепатит-ассоциированную, поствирусную и лекарственную форму различной степени тяжести.
МКБ-10. Апластической анемии присвоен код D61.9.
Причины
Исследователи доказали, что угнетение гемопоэза обусловлено возникновением в крови и костном мозге естественных киллеров и цитотоксических T-лимфоцитов, которые подавляют пролиферацию гемопоэтических клеток-предшественников.
К ряду основных причин развития АА относят:
- Взаимодействие с вредными химическими и физическими агентами (мышьяк, гербициды, соли золота и металлов, бензольные соединения и др.), а также высокодозное ионизирующее облучение.
- Использование медпрепаратов с миелотоксическим эффектом, в том числе, цитостатиков, психотропов, антибактериальных, антитиреоидных и других средств. Развитие тяжелой формы апластической анемии нередко провоцирует прием нестероидных противовоспалительных средств.
- Поражение вирусными агентами. Наиболее часто апластическую анемию вызывает перенесенный гепатит. Реже подавлению миелопоэза способствует грипп, цитомегалия, доброкачественный лимфобластоз, вирус иммунодефицита человека.
Кроме того, АА развивается на фоне наследственности, туберкулеза, иммунных заболеваний (карцинома тимуса, синдром Шульмана, гипогаммаглобулинемия и т.д.), интоксикации, лучевой болезни. Были описаны случаи анемии, вызванной беременностью. Апластические анемии без выявленной причины развития, относят к идиопатической форме.
Симптомы и диагностика
Для гипопластической анемии характерно постепенное нарастание симптомов. Острое течение болезни отмечается в редких случаях. К ранним проявлениям симптоматики патологии относятся следующие признаки:
- мышечная слабость,
- снижение двигательной активности,
- одышка,
- головокружение,
- головная боль.
По мере ухудшения состояния у больного отмечаются такие признаки: бледность поверхности кожи и слизистых, частые кровоизлияния и кровотечения. На поздних стадиях заболевания формируются неврологические нарушения, вызванные кровоизлияниями в головной мозг.
При постановке диагноза у людей, страдающих апластической анемией, доктора применяют следующие диагностические методы:
- уточнение симптоматической картины,
- общий анализ крови и мочи,
- исследование каловых масс на наличие скрытой крови,
- биохимический анализ,
- иммунологическое тестирование,
- электрокардиограмму,
- ультразвуковое обследование брюшной полости.
Патогенез
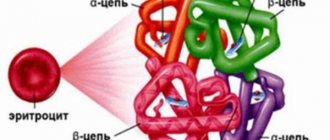
Нарушение дифференцировки или повреждение гемопоэтических стволовых клеток лежит в основе патогенеза апластической анемии. В случае приобретенной формы болезни на фоне влияния этиологических факторов активируются Т-лимфоциты, вырабатывающие пептидные информационные молекулы (цитокины), которые поражают клетки-предшественники кроветворения, что приводит к пангемоцитопении. Врожденной апластической анемии предшествуют кариотипические отклонения от нормы, вследствие которых нарушается восстановление дезоксирибонуклеиновой кислоты и прекращается процесс синтеза стволовых клеток.
Классификация
Различают врожденные (конституциональные) и приобретенные формы Гипопластической анемии. Врожденные Гипопластические анемии встречаются сравнительно редко. В зависимости от характера угнетения кроветворения выделяют формы с поражением всех трех ростков (истинная Г. а.) или только эритропоэза (парциальная Г. а.). Иногда выделяют Г. а. с гемолитическим компонентом, но некоторые авторы считают, что она представляет собой гипопластическую стадию пароксизмальной ночной гемоглобинурии (см. Гемолитическая анемия).
Симптомы апластической анемии
Дефицит тромбоцитов, лейкоцитов и эритроцитов сопровождается следующими проявлениями:
- Геморрагический синдром, при котором отмечается повышенная кровоточивость десен, меноррагии, появление петехий, носовые кровотечения. При тяжелых формах АА возможны желудочно-кишечные и маточные кровотечения, гематурии (наличие крови в моче).
- Анемический синдром характеризуется частыми головокружениями, повышенной утомляемостью, общей слабостью. Часто у пациентов наблюдается одышка, бледность кожи, покалывания в области сердца, учащенный пульс, головные боли, шум в ушах.
- Инфекционные осложнения. Недостаток лейкоцитов в крови приводит к частым инфекционным заболеваниям (ОРВИ, пневмония, стоматит и др.), которые плохо поддаются терапии.
В случае врожденной апластической анемии симптоматика проявляется у детей до 9-10 лет. Кроме аплазии костного мозга наблюдается микроцефалия (недоразвитие черепа и мозга), порок развития мочеполовой системы у мальчиков, гипоплазия почек, тугоухость. Также врожденная апластическая анемия у детей может сопровождаться аномалиями конечностей, низкорослостью, гиперпигментацией кожи.
Чтобы получить более подробную информацию или консультацию специалиста по орфанным заболеваниям, заполните все поля формы. Наши консультанты будут рады Вам помочь.
Прогноз
Апластическая анемия не предполагает единого прогноза. Исход болезни во многом зависит от формы заболевания, его тяжести, остроты течения.
Примерно в 50% случаев удается достигнуть стойкой ремиссии. Прогноз более благоприятен у детей, а также при увеличенном содержании ретикулоцитов.
Трансплантация костного мозга при условии полной совместимости с донором обеспечивает полное излечение в более чем 80% случаев. Если используются неродственные доноры, то вероятность успеха ниже и складывается из многих факторов, но прогрессирование возможностей медицины регулярно улучшает прогноз.
Прогноз неблагоприятен в случае быстрого прогрессирования болезни, возникновения тяжелого геморрагического синдрома и развития инфекционных осложнений. В ряде случаев патология приводит к острому лейкозу.
При апластической анемии существует риск летального исхода. Это связано с возможностью кровоизлияния во внутренние органы, фатальным кровотечением, инфекционными осложнениями, анемической комой.
Пятилетняя выживаемость при апластической анемии составляет 85%. Прогноз зависит от возраста пациента – для детей и молодых людей адекватное лечение обеспечивает 90% случаев пятилетней выживаемости, для пациентов после 40 лет этот показатель ниже – 75%.
Отсутствие лечения апластической анемии чревато летальным исходом. Смерть обычно наступает в течение нескольких месяцев.
Иммунодефицит может спровоцировать развитие оппортунистических инфекций – вирусных, бактериальных, грибковых. Существует также риск осложнений при медикаментозной терапии. В основном это побочные реакции лекарственных препаратов в виде сывороточной болезни, вторичного гемохроматоза.
Диагностика
При подозрениях на апластическую анемию для безошибочной постановки диагноза врачи после физикального осмотра назначают комплексное обследование, состоящее из следующих процедур:
- Клинический анализ крови, определяющий компонентную долю всех трех видов кровяных клеток, а также уровень ретикулоцитов и гемоглобина.
- МРТ, КТ — методы исследования масштабности поражения костной ткани, состояния внутренних органов, лимфатических узлов.
- Биопсия костного мозга — забор биоптата костного мозга для цитогистологии, позволяющей выявить патоизменения в системе кроветворения и составе крови, установить степень тяжести АА.
- Молекулярно-генетические тесты на предмет хромосомных аномалий.
Кроме того, пациентам назначают рентгеновскую томографию и рентген грудной клетки, УЗИ малого таза и брюшной полости, эхокардиографию. АА дифференцируют с лейкемией миелодиспластическими синдромами и разными видами анемии.
Дополнительные анализы при подозрении на анемию
После проведения общего анализа и выявления скорости обмена железа могут назначать другие обследования:
- анализы на маркеры воспаления, если выявлены симптомы аутоиммунных или ревматических заболеваний;
- установление уровня содержания фолитов и витамина В12.

Проводимые виды исследования помогают выявить этиологию наиболее распространённых типов малокровия.
В ряде случаев могут назначаться дополнительные обследования и анализы крови для более точной диагностики анемии:
- микроскопия мазка крови;
- УЗИ внутренних органов;
- костномозговая пункция (миелограмма);
- обследование кишечника и желудка (эндоскопия);
- анализ мочи;
- электрокардиограмма.
Эти методы диагностики применяют, когда трудно установить точное происхождение анемии.
Для установления конкретного вида заболевания предполагается выявление характерных показателей:
- количество фолиевой кислоты, которая находится в эритроцитах: проводят, если есть показания, биопсию костного мозга (подозрение на фолиеводефицитную анемию);
- количественное значение витамина В12: если не определяется уровень витамина, назначают аспирационную биопсию (подозрение на В12-дефицитную анемию);
- показатель уровня наличия билирубина в моче и сыворотке: выявляют стойкость эритроцитов, проводят пробу Кумбса (наличие гемолитической анемии).
Если есть подозрение на гипопластическое малокровие, которое характерно сбоем кроветворения костного мозга, определяют процесс и степень разрушения эритроцитов. Проводят исследование на наличие билирубина в кале и моче. Также назначают УЗИ печени и селезёнки для определения их размера.
При определении анемии, вызванной заболеваниями хронического характера, наряду с определением стандартных лабораторных показателей, проводят определение содержания ферритина вместе с выявлением уровня С-реактивного белка. Этот элемент указывает на стадию воспаления.
Лечение апластической анемии
Для пациентов с гипопластической анемией в больницах функционируют спецотделения, где обеспечивают абсолютную изоляцию и стерильные условия, что исключает осложнения на фоне инфекций. Разработка протокола лечения зависит от тяжести течения болезни, сопутствующих патологий. В терапевтическую программу входит несколько методов:
- Применение антибактериальных, противовирусных и анаболических препаратов, а также иммунодепрессантов, гликопротеидов, стероидных гормонов.
- Поэтапная иммуносупрессивная терапия, при которой в течение года и более используют антитимоцитарный глобулин и циклоспорин А. Данные средства улучшают функцию кроветворения и позволяют добиться длительной выживаемости. Абсолютные противопоказания к иммуносупрессивной терапии — дыхательная и сердечнососудистая недостаточность, тяжелые соматические состояния.
- Трансфузионная терапия — переливание донорского тромбоконцентрата и эритроцитарной массы с целью восполнения дефицита кровяных телец. Может также потребоваться дискретный плазмаферез (очищение плазмы центрифугированием).
При неэффективности других вариантов лечения сверхтяжелой формы апластической анемии хирурги проводят аллогенную трансплантацию костного мозга (ТКМ), которая является хорошей перспективой для долгосрочного выживания. Если для пересадки стволовых клеток нет совместимого донора, врачи пересаживают реципиенту донорские клетки периферической крови. При апластической анемии умеренной степени тяжести могут назначать малоинвазивную спленэктомию (тотальное удаление селезенки).
Лечение гипопластической анемии
Медикаментозное лечение — препараты
- Глюкокортикостеройдов (преднизолона), показан в качестве стимулятора всех звеньев кроветворения (курс лечения от месяца до 3-4)
- Анаболические стеройды (неробол, оксиметолон), также стимулирует кроветворение. Назначаются только после удаления селезенки
- Андрогенные препараты, назначаются только мужчинам (тестостерон), длительным курсом лечения, так как эффект нарастает постепенно, стимулируют эритропоэз
- Иммунодепрессанты (цитостатики, антилимфоцитарный глобулин, циклоспорины). Назначаются только при аутоиммунной форме гипопластической анемии. Курс лечения 2-3 месяца, с постепенным уменьшением дозировки
- Введение колониестимулирующего фактора, назначается для увеличения числа лейкоцитов (в основном нейтрофилов), дабы уменьшить вероятность инфекционных осложнений
- Введение иммуноглобулина. Короткий 5-дневный курс с целью стимулирования эритро и тромбоцитопоэза.
Внутривенные вливания
- Трансфузии эритроцитов (вымытые кровяные клетки)
- Трансфузии тромбоцитов (от одного донора).
Оперативные вмешательства
- Удаление селезенки в большинстве случаев дает хорошие результаты (особенно при аутоиммунном механизме развития анемии)
- Пересадку костного мозга проводят с подбором донора с учетом полной совместимости по HLA-системе, при продолжительности течения анемии не более 3-х месяцев и в молодом возрасте. Пересадке предшествует иммунодепрессивная терапия и облучение.